Definizioni di Termodinamica
La termodinamica è quella branca della fisica e della chimica fisica che descrive le trasformazioni subite da un sistema in seguito ad un processo di scambio di energia con altri sistemi o con l'ambiente esterno.
La termodinamica classica si basa sul concetto di sistema macroscopico, ovvero una porzione di materia fisicamente o concettualmente separata dall'ambiente esterno, che spesso per comodità si assume non perturbato dallo scambio di energia con il sistema. Lo stato di un sistema macroscopico che si trova all'equilibrio è specificato da grandezze dette variabili termodinamiche o di stato come la temperatura, la pressione, il volume, la composizione chimica.
Tuttavia esiste una branca della termodinamica, denominata Termodinamica del non equilibrio che studia i processi termodinamici non-lineari caratterizzati dal mancato raggiungimento di condizioni di equilibrio stabile.
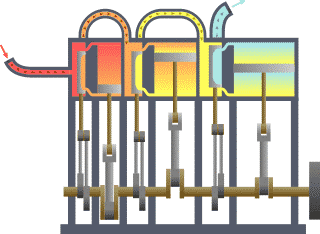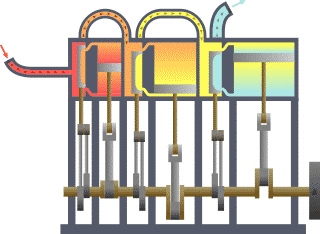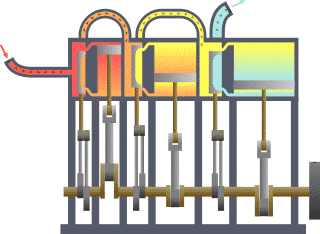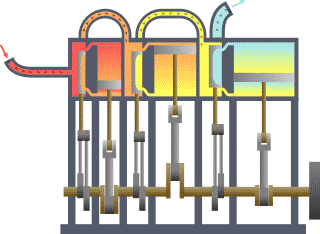
Breve sviluppo storico
modificaFu Sadi Carnot nel 1824 il primo a dimostrare che si può ottenere lavoro dallo scambio di calore tra due sorgenti a temperature differenti. Attraverso il teorema di Carnot e la macchina ideale di Carnot quantificò questo lavoro e introdusse il concetto di rendimento termodinamico.
Nel 1848 Lord Kelvin utilizzando la macchina di Carnot introdusse il concetto di temperatura termodinamica assoluta e a lui si deve un enunciato del Secondo principio della Termodinamica.
Nel 1850 Joule dimostra l'uguaglianza delle due forme di energia (allora si credeva esistesse ancora il fluido calorico).
A questo punto si era posto il problema che se era possibile ottenere calore dal lavoro in modo totale, non era possibile ottenere l'inverso. A questo risultato approda anche Clausius che nel 1855 introdusse la sua disuguaglianza per riconoscere i processi reversibili da quelli irreversibili e la funzione di stato entropia.
Sistemi termodinamici
modificaUn sistema termodinamico è una porzione di spazio, separata dal resto dell'universo (cioè l'ambiente esterno) mediante una superficie di controllo (superficie reale o immaginaria, rigida o deformabile), sede di trasformazioni interne e scambi di materia o energia con l'ambiente esterno
Si possono distinguere vari tipi di sistemi, in dipendenza dal modo di scambiare energia con l'esterno:
- sistemi isolati: non scambiano calore, materia, lavoro con l'esterno;
- sistemi chiusi: scambiano energia (calore, lavoro), ma non materia con l'esterno. Quando un sistema scambia calore, lavoro o entrambi, lo si può classificare in base alle proprietà al bordo:
- bordo adiabatico: non permette scambio di calore;
- bordo rigido: non permette scambio di lavoro;
- sistemi aperti: permettono scambio di energia e materia con l'esterno. Un contorno che permette scambio di materia è detto permeabile (o semipermeabile, se lascia passare solo determinate specie chimiche).
Trasformazioni termodinamiche
modificaQuando un sistema passa da uno stadio di equilibrio ad un altro, si dice che avviene una trasformazione termodinamica: si distingue tra trasformazioni reversibili, ovvero quelle trasformazioni che consentono di essere ripercorse in senso inverso (si ritorna precisamente al punto di partenza, ripercorrendo all'indietro gli stessi passi dell'andata), e trasformazioni irreversibili, ovvero quelle trasformazioni che, se ripercorse all'indietro, non faranno ritornare al punto iniziale, ma ad uno diverso. Perché una trasformazione sia reversibile è necessario che essa avvenga abbastanza lentamente da permettere al sistema di termalizzare (il sistema deve passare attraverso infiniti stati di equilibrio termodinamico).
